Le neurofeedback pour traiter le TDAH (hyperactivité, inattention, impulsivité)
Déficit de l’Attention / Hyperactivité (TDAH) Complexité, Paradigme et Neurofeedback
1.- Critères diagnostic DSM-5 du Déficit de l’Attention / Hyperactivité (TDAH) :
2.- Complexité du TDAH chez les enfants et les adolescents
3.- TDAH : trouble neurobiologique a influence sociétale ?
4.- Efficacité du traitement par Neurofeedback pour le TDAH : effets sur l’inattention, l’impulsivité et l’hyperactivité : une méta-Analyse
4- Efficacité du traitement par Neurofeedback pour le TDAH : effets sur l’inattention, l’impulsivité et l’hyperactivité : une méta-Analyse
Martijn Arns, Sabine de Ridder, Ute Strehl, Marinus Breteler and Anton Coenen
Mots Clés
Trouble du déficit de l’attention avec hyperactivité. Rétroaction biologique de l’EEG. Neurofeedback
Hyperactivité. Impulsivité. Inattention. Méta-analyse
RÉSUMÉ
Depuis les premiers rapports sur le traitement par neurofeedback pour le Trouble du Déficit de l’Attention avec Hyperactivité (TDAH) en 1976, beaucoup d’études ont analysé les effets du neurofeedback sur les différents symptômes du TDAH comme l’inattention, l’impulsivité et l’hyperactivité. Cette méthode est également utilisée par beaucoup de professionnels, mais la question de la fiabilité des preuves de ce traitement n’était pas encore claire. Dans cette étude, nous avons collecté des recherches sur le traitement par Neurofeedback pour le TDAH et une méta-analyse a été réalisée.
Les études prospectives et les études employant une conception préalable et postérieure contrôlées ont montré des Tailles d’Effets (TE) importantes du neurofeedback sur l’impulsivité et sur l’inattention, et une TE modérée sur l’hyperactivité. Des études randomisées ont montré une TE plus faible sur l’hyperactivité suggérant que l’hyperactivité est probablement plus sensible aux facteurs de traitement non-spécifiques.
En raison de la prise en compte d’études très récentes et rigoureuses dans cette méta-analyse, des facteurs potentiellement troublants tels que de petites études, le manque de randomisation dans de précédentes études et le manque de groupe de contrôle adaptés ont été relevés et l’effet clinique du neurofeedback sur le traitement de TDAH peut être considéré comme cliniquement significatif.
Trois études randomisées ont utilisé un groupe de contrôle semi-actif pouvant être considéré comme un subterfuge crédible fournissant le même niveau d’entraînement cognitif et de relation patient-thérapeute.
Par conséquent, en accord avec les directives de l’AAPB et de l’ISNR pour l’évaluation de l’efficacité Clinique, nous avons conclus que le traitement par neurofeedback pour le TDAH peut être considéré comme “Efficace et précis” (Niveau 5) avec une TE importante sur l’inattention et sur l’impulsivité et une TE modérée sur l’hyperactivité.
INTRODUCTION
En 1976, Lubar et Shouse1 ont été les premiers à étudier l’EEG et les altérations de comportement chez un enfant hyperkinétique après avoir entraîné le rythme sensorimoteur (RSM : 12-14 Hz). La logique derrière l’utilisation de l’entraînement du RSM pour le syndrome hyperkinétique repose sur le fait que le comportement le plus caractéristique de ce rythme est l’immobilité,2,3 une réduction de la tension musculaire qui accompagne l’entraînement du RSM3 et une production excessive de RSM chez les quadriplégiques et les paraplégiques4, suggérant que l’amélioration de ce rythme par un conditionnement adapté diminue les plaintes hyperkinétiques. En utilisant un modèle ABA chez un patient, Shouse et Lubar5 ont également montré que les symptômes de l’hyperactivité ont diminué quand le RSM était accru et qu’ils ont augmenté quand le RSM était inhibé. Plusieurs variations de ce protocole d’entraînement ont été développées et testées au long des années, comme l’amélioration du bêta et l’inhibition du thêta, l’amélioration du RSM et l’inhibition du bêta, etc. Pour une explication détaillée de ces différents protocoles, voir également Monastra6.
En 2004, Heinrich et al.7 ont été les premiers à rapporter des résultats positifs de neurofeedback Potentiel Corticaux Lents (SCP) dans le traitement du Trouble du Déficit de l’Attention avec Hyperactivité (TDAH). Le neurofeedback SCP neurofeedback est différents des approches mentionnées ci-dessus du fait que les changements dans la polarité de l’EEG sont récompensés (par ex., positivité vs. négativité dans l’EEG) et qu’un schéma de récompense discrète est utilisé. Curieusement, les approches de neurofeedback SCP et de RSM ont été utilisées avec succès également pour le traitement de l’épilepsie (pour un aperçu consulter Egner and Sterman8) et sont conseillées pour réguler l’excitabilité corticale 8,9. Plusieurs études ont comparé l’entraînement bêta et thêta et l’entraînement SCP chez des sujets10 et entre sujets11, et les deux approches ont montré des effets comparables sur les différents aspects du TDAH comme l’inattention, l’hyperactivité et l’impulsivité. De plus, l’entraînement RSN provoque aussi une positivité concurrente, suggérant que les deux approches modulent l’activité au sein du même réseau neurophysiologique sous-jacent. (Pour un aperçu des interrelations RSM-SCP, consulter Kleinnijenhuis et al.9).
Le constat initial de Lubar et Shouse1 et de Heinrich et al.7 ont stimulé un nombre considérable de recherches dans le traitement du TDAH avec le Biofeedback EEG ou le neurofeedback. Des praticiens utilisent actuellement cette thérapie dans l’exercice de leurs fonctions. Par conséquent, la question se pose quant à la fiabilité des preuves de la thérapie neurofeedback dans le traitement du TDAH et son importance dans le traitement du TDAH.
Les Directives pour l’Évaluation de l’Efficacité Clinique des Interventions Psychophysiologiques12 validées par l’International Society for Neurofeedback and Research (ISNR) et l’Association for Applied Psychophysiology and Biofeedback (AAPB) et similaires à celles de l’American Psychological Association (APA) précise cinq types de classifications allant de “Non validé empiriquement” à “Efficace et précis”. Ces niveaux ont été définis comme suit :
Niveau 1 : non validé empiriquement. Cette classification est attribuée aux traitements qui ont seulement été décrits et validés par des rapports anecdotiques et/ou des études de cas dans des journaux sans comité de révision.
Niveau 2 : possiblement efficace. Cette classification est considérée comme appropriée pour les traitements qui ont été recherchés dans au moins une étude ayant un impact statistique suffisant, des mesures de résultats bien identifiées, mais pour lesquels il manque une condition d’affectation randomisée à un contrôle inclus dans l’étude.
Address request for reprints to Dr. Martijn Ams, Brainclinics Diagnostics, Bijleveldsingel 34, 6524 AD Nijmegen, The Netherlands.
Email : martijn@brainclinics.00m
Received : January 30, 2008 ; accepted : May 15, 2009)
Niveau 3 : probablement efficace. Les approches de traitements qui ont été évaluées et qui ont démontré produire des effets bénéfiques dans de multiples études d’observation, des études cliniques, des études de contrôle, et des répétitions d’études au sein de sujets et entre sujets méritent cette classification.
Niveau 4 : efficace. Pour pouvoir être considéré “efficace,” un traitement doit respecter les critères suivants : (a) comparé à un groupe de contrôle sans traitement, un groupe de traitement alternative, ou un contrôle placebo utilisant une attribution randomisée, le traitement évalué s’est montré statistiquement supérieur, de manière significative, au contrôle, ou le traitement évalué est équivalent à un traitement à l’efficacité précédemment prouvée dans une étude suffisamment précise pour détecter les différences modérées ; (b) les études ont été réalisées sur une population traitée pour un problème spécifique, pour qui les critères d’acceptabilité ont été définis de manière précise, pertinente et applicable ; (c) l’étude a utilisé des mesures valides et clairement identifiées par rapport au problème traité ; (d) les données ont fait l’objet d’une analyse de données pertinente ; (e) les variables et les procédures du traitement sont clairement définies de manière à permettre sa répétition par des chercheurs indépendants, et (f) la supériorité ou l’équivalence du traitement évalué a été démontrée dans deux études indépendantes minimum.
Niveau 5 : efficace et précis. Pour respecter les critères de cette classification, le traitement doit avoir été démontré comme étant statistiquement supérieur à un traitement placebo crédible par thérapie ou par comprimé sérieux dans deux études indépendantes minimum.
Monastra et al.6 ont réalisé une revue critique de la littérature et ont appliqué les directives mentionnées. Il a été conclus que le traitement par Neurofeedback pour le TDAH pouvait être considéré de “Niveau 3 : probablement efficace.” Cependant, la même année, Loo et Barkley ont publié un article de révision où ils ont conclu que … la promesse du Biofeedback EEG comme traitement légitime ne peut être respectée sans études scientifiquement rigoureuses.” (13 page 73). Le principal problème qu’ils soulèvent est le manque d’études randomisées contrôlées, la petite taille des groupes et le manque de preuves indiquant que le Feedback EEG est à lui seul responsable des bénéfices cliniques et des facteurs non spécifiques comme le temps additionnel passé avec le thérapeute ou “l’entraînement cognitif.” En 2006, Holtmann and Stadtler14 ont conclu que le Biofeedback EEG a acquis un apport empirique durant les dernières années, mais le besoin d’études d’évaluations empiriques et sérieuses est toujours important. Une fois ces conclusions, basées sur la même littérature, données, une approche plus quantitative pourrait être justifiée pour définir un niveau de preuve du traitement par Neurofeedback pour le TDAH incluant également d’autres études qui répondent aux questions soulevées.
Jusqu’à aujourd’hui aucune étude de méta-analyse quantitative n’a été faite sur ce sujet. Une méta-analyse fournit une approche pertinente pour intégrer beaucoup d’études et examiner un effet général entre les études. Une telle analyse pourrait répondre aux questions soulevées et pour tester l’effet d’ampleur — et de ce fait la pertinence clinique — de ces méthodes d’un point de vue quantitatif. Comme le TDAH est caractérisé par des symptômes persistants d’inattention, d’impulsivité et/ou d’hyperactivité15, nous étudierons, dans cette analyse, les effets du Neurofeedback et des médicaments stimulants sur les principaux symptômes du TDAH : Hyperactivité, inattention et impulsivité.
MÉTHODE
Sélection des études
Les recherches sur la littérature se sont concentrées sur le neurofeedback ou le Biofeedback EGG chez les enfants souffrant de TDAH (troubles de l’attention et de l’hyperactivité). Dans cette optique, la compilation bibliographique de Hammond16 a servi de première base. De plus, une recherche a été faite sur PubMed en utilisant les mots clés suivants : “neurofeedback” ou “Biofeedback EEG” ou “neurothérapie” ou “SCP” ou ” Potentiels Corticaux Lents” et “TDAH” ou “TDA” ou “Trouble du Déficit de l’Attention avec Hyperactivité” ou “Trouble du Déficit de l’Attention.” De plus, plusieurs auteurs ayant présenté des études sur le TDAH lors de conférences (ISNR et Society for Applied Neuroscience (SAN)) au cours des 2 dernières années ont été contactés pour obtenir de potentielles études en cours de publication.
Toutes ces publications ont été récupérées et analysées pour les critères d’inclusion. La liste références des articles a également été vérifiée pour détecter tout oubli d’étude. Afin de garantir la qualité scientifique, les travaux devaient être publiés dans un périodique avec comité de révision ou faire partie d’une thèse de Doctorat.
Les conceptions devaient suivre les critères suivants : les sujets traités devaient avoir un premier diagnostic de TDAH/TDA ; (1) contrôlé entre les études de conception des groupes de contrôle de sujets qui ont utilisé un médicament stimulant passif (liste d’attente) ou actif (médication stimulante ; biofeedback ; entraînement cognitif), randomisé ou non ; ou (2) des études de conception prospectives au sein du sujet ou (3) des études de conception rétrospectives au sein du sujet avec un échantillon assez large pour fournir une représentation pertinente de l’activité (N>500).
Le traitement par Neurofeedback a été fourni de manière standardisée, et seulement deux protocoles de traitement ont été utilisés. Les moyens standardisés de pré et post évaluation et les Déviations Standard (SD) pour au moins 1 des domaines suivant devaient être : Hyperactivité, inattention ou erreurs de commission CPT commission. Lorsque les moyens et les SD d’une étude n’étaient pas disponibles, ils ont été demandés aux auteurs. Tous les auteurs n’ont pas répondu ou n’étaient plus en mesure de récupérer cette information, et si l’information disponible n’était pas suffisante, l’étude a été exclue de la méta-analyse.
Étude groupée
Dans le suivi par Neurofeedback, plusieurs protocoles de traitement sont utilisés, comme l’amélioration du RSM associée à la suppression de thêta, l’amélioration de bêta avec la suppression de thêta, et le traitement de Potentiels Corticaux Lents (SCP). La majorité des études utilisent les zones centrales (Cz, C3, C4) comme point de suivi et une minorité ont pris en compte les zones frontales (Fz, FCz). Pour respecter la majorité de la littérature sur les bandes de fréquences EEG, nous avons organisé les suivis RSM/thêta et bêta/thêta comme traitement bêta/thêta dans cette méta-analyse, étant donné que la bande de fréquence (12-15 Hz) fait partie du spectre de fréquence bêta-1. De plus, comme expliqué dans l’introduction, les neurofeedback SCP et thêta/bêta ont démontré des effets comparables sur les différents aspects du TDAH comme l’inattention, l’hyperactivité et l’impulsivité. Par conséquent, dans la méta-analyse, les protocoles de neurofeedback SCP et thêta-bêta sont examinés dans la même analyse. Le résultat de cette méta-analyse sera révisé ultérieurement pour les effets différenciés des différents protocoles d’entraînement.
Collecte de données
Les mesures pré et post évaluation suivantes ont été collectées des études incluses : (1) Hyperactivity : assessed with a DSM rating scale such as Conners (CPRS-R) ; ADDES-Home, BASC, SNAP, FBB-HKS (parents) or DSM-IV Rating Scale (Lauth and Schlottke) ; (2) inattention : assessed with an inattention rating scale such as FBBHKS, Conners (CPRS-R, BASC, ADDES-Home, SNAP/lowa-Conners) or DSM-IV Rating Scale (Lauth and Schlottke) ; (3) impulsivity : commission errors on a CPT such as a TOVA, IVA (auditory prudence measure) or Go-NoGo test.
Ces mesures ont été utilisées comme paramètres de traitement.
Méta-Analyse
Dans la méta-analyse, les Tailles d’Effets (TE) sont calculées sur la base des moyennes de pré-traitement et de post-traitement et de la déviation standard extraite des études incluses dans la méta-analyse. Ces résultats, dans un intervalle de TE de 95% de confiance par étude. Une TE est une statistique sans échelle, permettant ainsi une comparaison des résultats avec plusieurs instruments. Basé sur de multiples études, une moyenne générale de la TE est calculée avec un intervalle de 95% de confiance fournissant le poids de la TE de toutes les études qui peut être considéré la TE véritable de la population. La TE des études est généralement présentée sous forme de graphique “forest plot” apportant une vue d’ensemble des résultats. La TE est vue comme une mesure de “pertinence clinique” dans la mesure où plus la TE est importante, plus la pertinence clinique est élevée.
Dans cette étude, deux TE ont été calculées. Tout d’abord pour la conception des études contrôlées de la TE entre sujets du groupe neurofeedback comparée au groupe de contrôle. Ces données ont été utilisées pour comparer la réussite après la thérapie par neurofeedback avec condition de contrôle. Comme des études ont utilisé un groupe de contrôle actif (médicament stimulant) ou un groupe de contrôle semi-actif (suivi de l’attention10,17, Biofeedback EMG17 ou thérapie de groupe18), la TE entre sujets a également été calculée et représentée sous forme de graphique pour tous les enfants souffrant de TDAH traités avec le neurofeedback des conceptions contrôlées et entre sujets.
Les TE ont été calculées avec la formule Hedges’ D en utilisant de pré-test SD19,20 combiné et les différences pre/post traitement pour les résultats des mesures des études contrôlées. Pour l’analyse entre sujets, les moyens pré/post traitement et les SD ont été utilisés pour calculer les TE. La moyenne générale des TE, à intervalle de confiance de 95%, le Qt (hétérogénéité de la TE) et le nombre “fail-safe” (méthode de Rosenthal : a<0.05) ont été calculés en utilisant MetaWin version 2.1.21 Le nombre “fail-safe” est le nombre d’études indiquant combien de résultats nuls non publiés sont nécessaires pour qu’un effet soit considéré non significatif.
Quand l’hétérogénéité totale d’un échantillon (Qt) était significative, indiquant que la variation des tailles d’effets est plus importante qu’attendue par les erreurs d’échantillonnage — les études ont été écartées de la méta-analyse une par une, et l’étude contribuant le plus à la pertinence de la valeur du Qt a été exclue des analyses suivantes pour cette variable jusqu’à ce que la valeur du Qt ne soit plus significative. Ceci a été fait sur 3 itérations maximum. Si plus de 3 études ont eu besoin d’être exclues pour obtenir une valeur de Qt non significative, d’autres variables explicatives doivent être choisies. Dans un tel cas, les résultats de cette variable ne seront pas réutilisés par la suite.
Analyse Post-Hoc
Les analyses Post-hoc ont été réalisées pour vérifier les différences potentielles entre les approches méthodologiques et la qualité des études. Les TE ont été soumises à une ANOVA unidirectionnelle pour analyser les variables suivantes : (1) Le protocole neurofeedback : RSM/Bêta/Thêta vs. Bêta/Thêta vs. protocoles SCP ainsi que protocoles SCP vs. tous les protocoles Bêta/Thêta ; (2) la date : les études antérieures à 2006 et les études postérieures à 2006 ont été comparées pour vérifier les différences de TE dans les études plus récentes ; (3) études utilisant la randomisation vs. études non-randomisées. Étant donné que l’attente est que les études randomisées présentent une TE plus faible, nous avons considéré une valeur-p inférieure à 0,1 significative (portée unilatérale) par l’utilisation d’un critère stricte pour cette dimension ; (4) Médicaments : études réalisées sur des sujets prenant un traitement vs. études réalisées sur des sujets ne prenant pas de médicaments.
Finalement, le coefficient de corrélation de Pearson a été défini entre le nombre moyen de séances et les TE. Comme il est attendu que plus le nombre de séances de la théorie d’apprentissage est élevé, plus les effets cliniques seront marqués, un test unilatéral a été réalisé.
RESULTATS
Quinze études ont respecté tous les critères et ont été inclues dans la méta-analyse. Un test randomisé contrôlé (TRC) de Linden et al.22 et une étude prospective (Lubar et al.23) ont été exclues de la méta-analyse car aucun SD n’était disponible pour ces études. Deux études contrôlées de placebo à double insu par deBeus24 et Picard25 et une étude contrôlée par Fine, Goldman and Sandford26 ont été exclues car elles n’étaient pas publiées et aucuns moyens ni SD n’étaient disponibles.
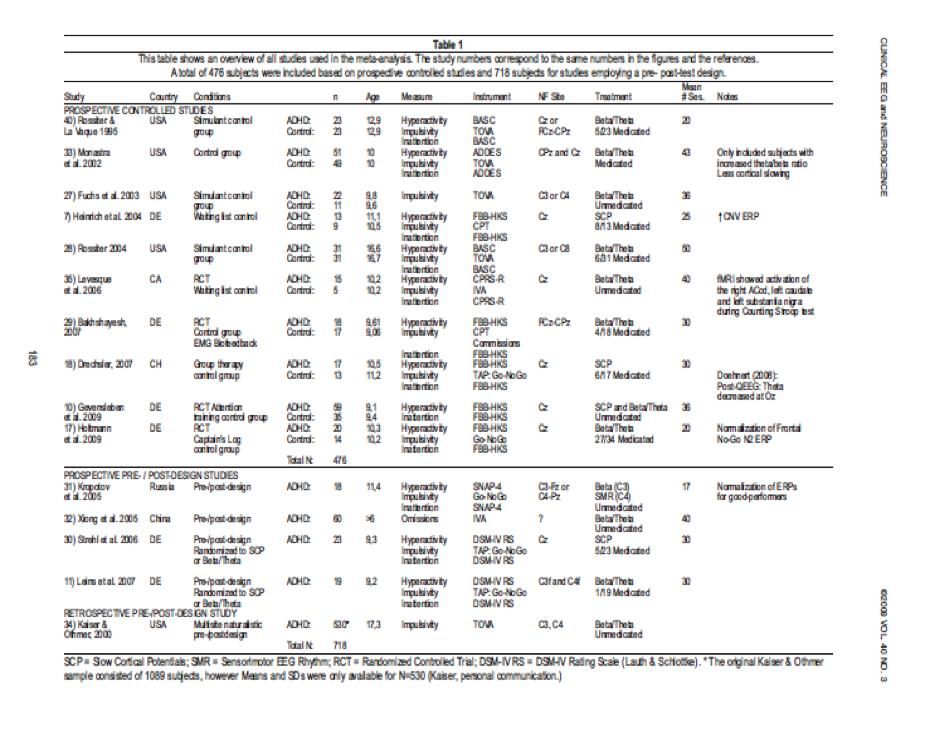
Toutes les études ont examiné les effets du neurofeedback chez les enfants. Une vue d’ensemble de toute les études incluses peut être consultée dans le Tableau 1. Le nombre total de sujets inclus dans la méta-analyse est de 476 pour les études contrôlées et de 718 pour les études de pré/post conception. Des chutes de taux ont été enregistrées dans seulement 5 études10,27-30 qui ne sont donc pas incluses dans le Tableau 1. Les chutes de taux ont été enregistrées aux alentours de 10% dans la plupart des études, pour les groupes de traitement et de contrôle.
Les calculs suivants ont été réalisés pour rendre les données compatibles avec la méta-analyse : Kropotov et al.31 ont rapporté des données basées sur un groupe de sujets performants (N = 71) et sur un groupe peu performant (N = 15). Xiong et al.32 ont rapporté des données basées sur 3 groupes d’enfants souffrant de TDAH (Inattention, Hyperactivité autres types de TDAH). Les moyens et SD de ces études ont été de ce fait recalculés pour l’ensemble de l’échantillon en utilisant la formule : SD = sqrt[n*sum(x^2)-(sum(x))^2)/(n(n-1))] pour les déviations standard. Toutes les données utilisées dans cette méta-analyse peuvent être téléchargées sur www.braindinics.com dans la partie « downloads ».
Études contrôlées prospectives
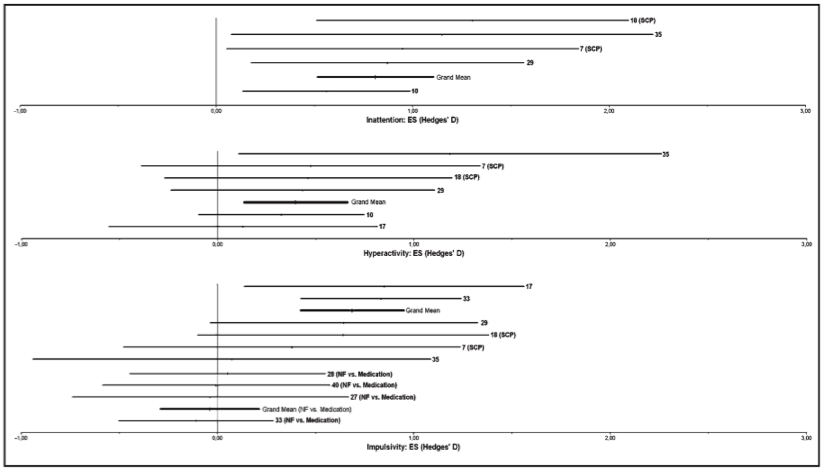
Il est important de noter qu’il existe deux types d’études contrôlées ; les études avec un groupe de contrôle passif ou semi-actif comme le groupe de contrôle de file d’attente, le biofeedback EMG et l’entraînement cognitif et les études avec un groupe de contrôle actif comme un médicament stimulant (traitement “gold standard” pour le TDAH). Ces études ont été analysées séparément. La figure 1 montre les résultats de la méta-analyse pour les études avec un groupe de contrôle passif (neurofeedback vs. groupe de contrôle) et un groupe de contrôle actif (neurofeedback vs. groupe de médicament stimulant). Une TE positive démontre une diminution des symptômes pour cette mesure. Pour l’impulsivité la TE du neurofeedback vs. groupe de médicament stimulant est proche de 0 ; suggérant que le neurofeedback a un effet similaire au médicament stimulant.
De plus, il est important de noter sur la moyenne générale de la TE de l’inattention (TE = 0.81) et de l’impulsivité (TA = 0.69) du neurofeedback comparé au groupe de contrôle. Pour l’hyperactivité et l’inattention il n’y a pas eu de données disponibles suffisantes pour une comparaison pertinente entre le méthylphénidate et le neurofeedback.
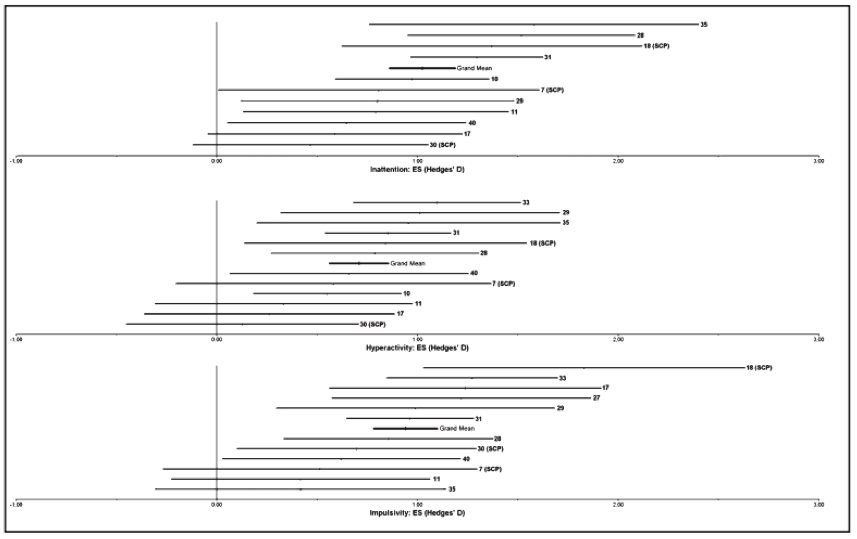
Le test de l’hétérogénéité a été significatif (Qt = 43.47, p = 0.0000 ; TE moyenne : 0.9903) signifiant que la variance entre la TE a été plus grande qu’attendue par les erreurs d’échantillons. Il a été montré que l’étude de Monastra et al.33 (ES = 2.22) et de Holtmann et al.17 (ES = -0.39) ont le plus contribué à la pertinence du Qt et ont donc été exclues de l’analyse.
La TE moyenne de l’inattention était 0.8097 (intervalle de confiance 95% (CI) 0.39-1.23 ; Total N = 201). Le test de l’hétérogénéité n’as pas été significatif (Qt = 3.31, p = 0.51). Le nombre “fail-safe” des études a été de 52.1, signifiant qu’au moins 52 résultats nuls non publiés sont nécessaires pour rendre l’effet du neurofeedback sur l’attention non significatif.
Hyperactivité
Le test de l’hétérogénéité a été significatif (Qt = 16.45, p = 0.01153 ; TE moyenne : 0.6583). Il a été montré que l’étude de Monastra et al.33 (TE = 1.36) a le plus contribué à la pertinence du Qt et a donc été exclue de l’analyse.
La TE moyenne de l’hyperactivité a été de 0.3962 (95% CI 0.05-0.75 ; Total N = 235. Le test de l’hétérogénéité n’a pas été significatif (Qt = 2.83, p = 0.726). Le nombre “fail-safe” des études a été de 15.4.
Ce graphique montre les “forest plots” pour les études contrôlées avec les Tailles d’Effets (TE) et leur intervale de 95% de confiance pour les études contrôlées, et les nombres correspondent aux études du Tableau 1. Les barres de Moyenne Générale sont le TE pour l’inattention, l’hyperactivité et l’impulsivité avec le “forest plot” pour l’impulsivité montrant les TE pour le neurofeedback comparé aux groupes de contrôle (moyenne générale supérieure) et le neurofeedback comparé au médicament stimulant (moyenne générale inférieure). Une TE positive montre une diminution plus importante des symptômes pour le groupe neurofeedback comparé au groupe contrôle. Il est clairement visible sur cette figure que la plupart des études ont une TE positive avec une Moyenne Générale modérée à élevée et significativement différente de zéro. On remarque également que la Moyenne Générale de la TE, pour la comparaison du neurofeedback avec le médicament stimulant est de presque 0 pour l’impulsivité, indiquant que les traitements ont des effets similaires.
Impulsivité
Neurofeedback vs. Group de Contrôle
La moyenne de la TE pour l’impulsivité a été de 0.6862 (95% CI 0.34-1.03 ; Total N = 241). Le test de l’hétérogénéité n’a pas été significatif (Qt = 2.63, p = 0.757). Le nombre “fail-safe” des études a été de 37.7.
Neurofeedback vs. Méthylphénidate
La moyenne de la TE pour l’impulsivité a été de -0.0393 (95% CI -0.45-0.37 ; Total N = 240). Le test de l’hétérogénéité n’a pas été significatif (Qt = 0.26, p = 0.967. Le nombre “fail-safe” des études a été de 0.
Effets sur les sujets
Dans la Figure 2 la TE chez le sujet est montrée pour toutes les études incluses dans la méta-analyse. La moyenne générale supérieure de la TE est à noter pour les 3 domaines. L’étude de Strehl et al.30 et de Leins et al.11 a montré une TE relativement basse pour l’hyperactivité et l’inattention. Ceci est probablement causé par le questionnaire basé sur le DSM-IV utilisé qui emploie seulement des réponses catégoriques (oui/non) alors que toutes les autres études utilisent des niveaux de réponse dimensionnels.
Inattention
Le test de l’hétérogénéité a été significatif (Qt = 26.07, p = 0.006 ; TE moyenne : 1.1126). L’étude de Monastra et al.33 (ES = 1.45)) a montré être celle qui a contribué de manière la plus significative au Qt. Cette étude a associé un plan de soins cliniques global avec le neurofeedback, ce qui peut expliquer en partie ces résultats. De plus, cette étude a sélectionné des sujets basés sur leur ratio élevé de thêta/bêta et par conséquent peut ne pas être représentatif pour le TDAH. Cette sélection peut avoir provoqué l’inclusion d’un sous-groupe de patients souffrant de TDAH qui répond particulièrement bien au neurofeedback, ce qui explique l’importance de la TE.
La TE moyenne pour l’inattention après avoir exclu cette étude a été de 1.0238 (95% CI 0.84-1.21 ; Total N = 324). Le test de l’hétérogénéité n’a pas été significatif (Qt = 16.26, p = 0.093) signifiant que la variance de la TE n’a pas été meilleur que celle attendue par l’erreur d’échantillons. Le nombre “fail-safe” des études a été de 508.6.
Ce graphique montre les “forest plots” de la TE de l’attention (TE = 1.02), de l’hyperactivité (TE = 0.71) et de l’impulsivité (TE = 0.94) chez les sujets. Toutes les TE sont montrées avec leur intervalle de 95% de confiance et les nombres correspondent aux études dans le Tableau 1. Il est clairement visible que toutes les études montrent des TE positives et plus significatives que 0, avec leur intervalle de 95% confiance.
Hyperactivité
La moyenne de TE pour l’hyperactivité a été de 0.7082 (95% CI 0.54-0.87 ; Total N = 375). Le test de l’hétérogénéité n’a pas été significatif (Qt = 13.57, p = 0.258) signifiant que la variance de la TE a été meilleur que celle attendue par l’erreur d’échantillons. Le nombre “fail-safe” des études a été de 320.3.
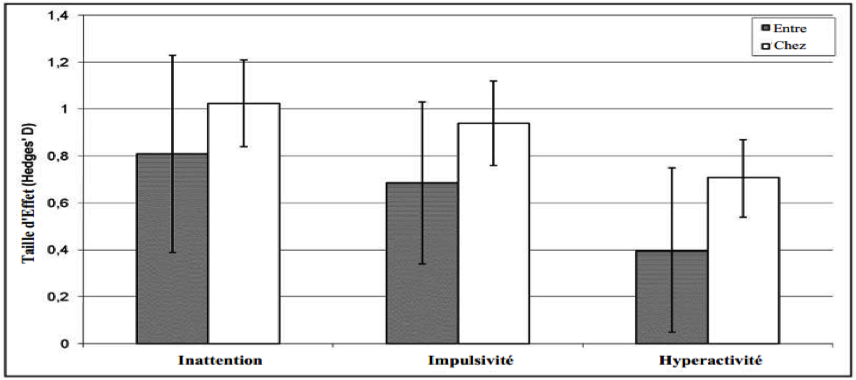
Cette figure montre la moyenne générale le la TE pour les études contrôlées comparée à la TE chez les sujets dans toutes les études pour les 3 symptômes. À remarquer, la TE pour les études contrôlées est légèrement plus petite, ce qui peut être expliqué par le fait que beaucoup d’études contrôlées ont des groupes de contrôle “semi-actifs”. De plus, avec l’intervalle de 95 % de confiance de la TE pour l’inattention, l’hyperactivité et l’impulsivité est significatif pour les deux comparaisons.
Impulsivité
Le test de l’hétérogénéité a été significatif (Qt = 24.93, p = 0.015 ; TE moyenne : 0.7487). Il a été montré que l’étude de Kaiser and Othmer34 (TE = 0.63) a contribué de la manière la plus significative au Qt. C’est également la seule étude naturaliste ; de ce fait, la TE a été calculée sans prendre cette étude en compte. La TE moyenne pour l’impulsivité a été de 0.9394 (95% CI 0.76-1.12 ; Total N = 338). ). Le test de l’hétérogénéité n’a pas été significatif (Qt = 16.15, p = 0.135) signifiant que la variance de la TE n’a pas été meilleure que celle attendue par l’erreur d’échantillons.
Le nombre “fail-safe” des études a été de 511.7.
La figure 3 montre la moyenne générale des études contrôlées comparées à la TE chez les sujets dans toutes les études pour les 3 principaux symptômes. À remarquer, la TE pour les études contrôlées est légèrement plus basse, ce qui peut être expliqué par le fait que beaucoup d’études contrôlées ont utilisé des groupes de contrôle “semi-actifs” tels que l’entraînement de l’attention10,17, le Biofeedback EMG29 ou la thérapie de groupe18. De plus, avec l’intervalle de 95% de confiance de la TE pour l’inattention, l’hyperactivité et l’impulsivité est significative pour les deux comparaisons.
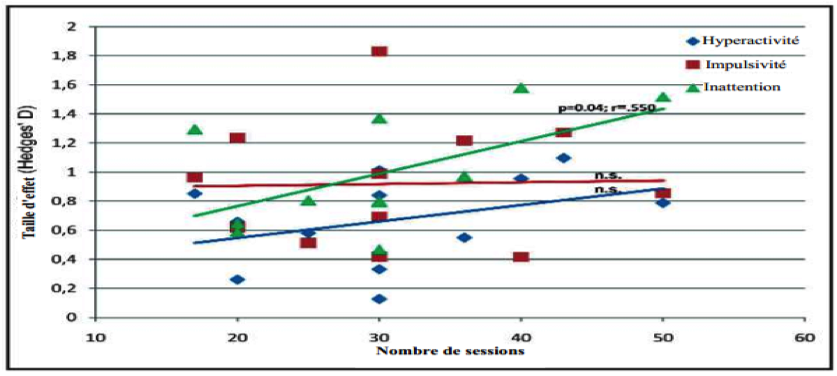
Cette figure montre la corrélation entre le nombre de sessions (horizontal) et la TE (vertical) pour les différentes études. Cette figure montre l’association de l’inattention (qui a été significative) et le fait qu’il existe un effet sur un plus grand nombre de sessions.
Analyse post-hoc
L’analyse post-hoc n’a révélé aucune différence dans les TE entre les études 1) avec les protocoles RSM/Thêta, Bêta/Thêta, RSM/Bêta/Thêta et neurofeedback SCP. Aucune différence non plus n’a été trouvée entre les études SCP et les études Bêta/Thêta et aucun effet n’a été trouvé par rapport au 2) Temps. Il est également possible de voir, sur le graphique “forest plots” qu’il n’y a pas de relation nette entre la TE et le temps. Aucune différence significative n’a été démontrée entre les études réalisée chez les sujets prenant des médicaments vs. ceux n’en prenant pas. Dans cette optique, la TE des études sur les sujets ne prenant pas de médicaments10,27,31,32,34,35 ont été confrontées aux autres études. La plupart des études ont inclus une minorité de sujets prenant des médicaments. Au total 113 sujets traités au neurofeedback prenaient des médicaments sur un total de 973 sujets (12%).
Pour la randomisation, il y a eu un effet significatif sur le niveau d’hyperactivité seulement (p = .080 ; F = 3.716 ; df = 1, 11), démontrant que la TE pour les études randomisées étaient plus faible (TE = 0.54) comparées aux études non randomisées (TE = 0.80). Pour l’inattention et l’impulsivité, il n’y a eu aucune différence.
Il y a eu une corrélation significative entre le nombre moyen de sessions dans les études et l’amélioration de l’inattention (p = 0.04 ; r = .550), mais pas pour l’impulsivité et l’hyperactivité, signifiant que de meilleurs effets sur l’inattention sont atteints avec plus de sessions, voir également Figure 4.
DISCUSSION
Cette étude a examiné les effets de la thérapie Neurofeedback sur les principaux symptômes de TDAH en utilisant une approche méta-analytique.
Quinze études ont rempli les critères, pour un total de 1194 sujets et une majorité d’études réalisées en Allemagne (6 études) et aux USA (5 études). Six études ont utilisé une distribution randomisée des sujets et 3 études ont comparé le neurofeedback avec des médicaments stimulant (le “gold standard” actuel dans le traitement de TDAH). L’étude de Bakhshayesh fait partie d’une thèse de doctorat, cependant ce manuscrit a également été soumis pour une publication dans une revue internationale (Bakhshayesh, communication privée).
Avec les études contrôlées de la méta-analyse il a paru évident que le neurofeedback a une TE importante36 sur l’inattention et l’impulsivité et une TE modérée sur l’hyperactivité.
Beaucoup de ces études contrôlées ont utilisé des groupes de contrôles semi-actifs tels qu’entraînement cognitif10,17, Biofeedback EMG29 ou thérapie de groupe18. Comme il est connu que le suivi peut par exemple améliorer les symptômes de TDAH comme l’inattention et l’hyperactivité/impulsivité37,38, les TE (Tailles d’Effets) chez le sujet ont également été calculées. Elles ont montré des TE importantes. Elles ont été significatives pour chacun des principaux symptômes : inattention, impulsivité et hyperactivité. Pour une vue d’ensemble des TE des études contrôlées ainsi que de celles des effets chez le sujet voir également la Figure 3.
Dans la Figure 1 il est clairement visible que les études de Bakhshayesh29, Gevensleben et al.10 et Holtmann et al.17 Ont les TE les plus basses pour l’hyperactivité. Ce sont exactement ces 3 études qui ont utilisé un groupe de contrôle semi-actif dans une conception randomisée. Le fait que la TE de l’hyperactivité a été significativement plus basse – tout en restant une TE modérée — pour les études randomisées suggère que l’hyperactivité est probablement plus sensible aux facteurs de traitement non spécifiques. De futures études devraient utiliser la randomisation afin d’apporter des preuves des effets du traitement sur l’hyperactivité.
Curieusement, les analyses post-hoc n’ont pas révélé de différence entre les différentes approches de neurofeedback utilisées comme thêta/bêta, thêta RSM et neurofeedback SCP ni de différence d’efficacité dans les 3 domaines. Étant donnée la logique de départ de Lubar et Shouse1 d’utiliser l’entraînement RSM pour de syndrome hyperkinétique, nous espérions une TE supérieure pour l’hyperactivité dans les études RSM/thêta. Cela n’a pas été le cas octroie plus de poids au fait que ces approches modifient l’activité dans le même système neurophysiologique sous-jacent. Cependant, des recherches plus approfondies sont nécessaires pour examiner cette question. Il n’y a non plus pas eu de différence entre les sujets des études de neurofeedback avec médicaments vs. sans médicaments. Seulement 12% des sujets de cette méta-analyse prenaient des médicaments. Bien qu’il n’ait pas été possible de séparer les effets à l’intérieur des études, ces résultats ont tendance à suggérer que les effets du neurofeedback sont similaires pour les patients prenant des médicaments et pour ceux n’en prenant pas. Des recherches plus approfondies sur l’impact des médicaments sur le neurofeedback sont également nécessaires.
Il existe plusieurs problèmes lors de l’interprétation de données de méta-analyse. Par exemple la sélection des études et des variables pertinentes est directement liée à la qualité des résultats de la méta-analyse. De plus, il existe une possibilité de biais de publication qui causent une TE plus élevée due aux résultats nuls non publiés, aussi appelé le “problème du placard à dossiers”21. Les nombres “fail-safe” en relation avec les nombres des études incluses ont été relativement élevés dans cette étude. Le nombre “fail-safe” est le nombre d’études indiquant combien de résultats nuls non publiés sont nécessaires pour qu’un effet soit considéré non significatif. Le nombre “fail-safe” pour les études contrôlées était de 15 pour l’hyperactivité, 52 pour l’inattention et 37 pour l’impulsivité. Le nombre “fail-safe” pour les études chez les sujets était de 320 pour l’hyperactivité et de plus de 500 pour l’inattention et l’impulsivité. Il semble peu probable qu’il existe autant d’études avec des résultats nuls qui n’ont pas été publiées.
Ce “problème du placard à dossiers” a été en outre traité par la sélection des paramètres de traitements et par les demandes additionnelles de données (non publiées) aux auteurs quand nécessaire. Les plupart des études ont enregistré de nombreux résultats, comme des échelles d’évaluation de données pour l’inattention et l’impulsivité et une variété des tests neuropsychologiques. Pour cette méta-analyse, nous avons spécifiquement défini les mesures pour y inclure les 3 domaines, comme l’échelle d’évaluation de l’hyperactivité et de l’inattention et la commission d’erreurs sur les tests CPT comme mesure de l’impulsivité . Comme la plupart des auteurs se concentreront sur leurs résultats les plus significatifs de leur étude pour leurs productions scientifiques, notre approche a visé à minimiser le risque de surestimation des tailles d’effets. Dans beaucoup de cas nous avons demandé les moyens et les SD pour la commission d’erreurs et/ou les échelles d’évaluation des données qui dans certains cas ne se sont pas révélées pertinentes pour cette étude.
Dans le passé plusieurs critiques ont été faites à propos d’études examinant l’efficacité du neurofeedback dans le traitement de TDAH, par exemple par Loo et Barkley13 et Holtmann and Stadtler14 en ce qui concerne la petite taille des échantillons, le manque de groupe de contrôle pertinent, de randomisation, l’indifférence par rapport aux résultats sur le long terme. Nous allons traiter ci-dessous les critiques faites suite aux nombreuses études récemment réalisées :
Randomisation
Dans cette méta-analyse, le besoin d’essais randomisés a été renforcé, étant donné que les TE ont été significativement plus faibles pour les essais randomisés de l’échelle de l’hyperactivité, mais pas pour l’inattention et l’impulsivité. La TE moyenne des études randomisées est restée modérée (ES = 0.54). De plus, dans cette méta-analyse, les résultats de 6 études randomisées ont été inclus, et tous montrent des résultats de TE modérés et élevés pour l’inattention et l’impulsivité et des TE basses à élevées pour l’hyperactivité. La randomisation est donc belle et bien nécessaire pour conduire des études fiables, mais nous pouvons conclure que les études randomisées montrent encore à ce jour des TE importantes pour l’inattention et l’impulsivité.
Taille des échantillons
Les études les plus importantes à ce jour sont celles de Monastra33 (N = 100), Gevensleben et al. (N = 94) et Kaiser and Othmer (étude originale N = 1089 ; données disponibles dans cette méta-analyse N = 530 ; Kaiser, communication privée). Les résultats des études de Monastra33 doivent être interprétées avec précaution car cette étude a été exclue de la plupart des analyses de par sa forte contribution à la TE de l’hétérogénéité (Qt). Ceci est probablement lié au fait que les sujets de cette étude ont reçus, en plus du neurofeedback et de la Ritaline, un programme de soins cliniques compréhensif, provoquant une TE plus élevée comparée aux autres études. De plus, l’étude de Monastra33 a seulement inclus des sujets avec un ratio thêta/bêta augmenté, et a ainsi potentiellement sélectionné les sujets qui pouvaient tirer le plus de bénéfices du traitement par neurofeedback. Les sujets de cette étude peuvent donc ne pas être représentatifs de la situation générale des personnes souffrant de TDAH population, qui peuvent être responsables de la TE élevée. L’étude de Gevensleben et al.10 est la plus sérieuse à étudier à ce jour, du point de vue méthodologique. Elle a inclus une randomisation, un large échantillon et une approche multi-centre. Cette étude a montré une TE modérée pour l’hyperactivité (TE = 0.55) et une TE importante pour l’inattention (TE = 0.97). Et enfin, l’étude de Kaiser and Othmer34 est la plus grande étude à ce jour. Pour l’impulsivité la TE a été modérée (TE = 0.63), mais cette valeur a été exclue de l’analyse car l’étude est celle qui a le plus contribué à l’hétérogénéité de la TE. Ceci peut probablement être expliqué par le fait que cette étude a été une étude naturaliste et a été la moins contrôlée d’un point de vue méthodologique incluse dans la méta-analyse. Cependant, cette TE modérée d’une grande étude naturaliste non contrôlée démontre encore une fois la validité écologique du neurofeedback dans l’activité clinique.
Enfin, la présente méta-analyse met également en évidence la question de la petite taille des échantillons en compilant toutes les études en une méta-analyse démontrant le problème de la taille des échantillons.
Groupes de contrôle pertinents
Beaucoup d’auteurs ont suggéré par le passé qu’une possible explication des effets du neurofeedback pouvait être les résultats de l’”entraînement cognitif” car les sujets participent à un exercice de feedback pendant généralement 30-50 sessions. De plus, il a été suggéré que le temps passé avec un thérapeute pouvait expliquer les effets du traitement. De telles préoccupations pourraient être résolues par des études contrôlées à double aveugle. Tout en ayant connaissance de la difficulté de réaliser une étude contrôlée à double aveugle avec un placebo pour le neurofeedback, qui peut grandement être associée à de grandes chutes des taux dans le groupe contrôle39, plusieurs groupes travaillent encore sur ce problème.
Par exemple, Gevensleben et al.10 et Holtmann et al.17 ont utilisé des groupes de contrôle qui ont été suivi de manière intensive et égale sur une tâche demandant de l’attention (entraînement cognitif informatisé) pour contrôler ces effets non spécifiques. De plus, Drechsler et al.18 ont utilisé un groupe de contrôle suivant une thérapie de groupe et Bakhshayesh29 a utilisé un groupe Biofeedback EMG comme groupe de contrôle. Dans toutes ces études le neurofeedback, comparé à ces groupes de contrôle semi-actifs, avait encore une TE modérée à élevée pour l’inattention et l’impulsivité, et une TE faible à modérée pour l’hyperactivité. Les groupes de contrôle utilisés pat Gevensleben et al.,10 Holtmann et al.17 et Bakhshayesh29 peuvent tout particulièrement être considérés un contrôle placebo crédible, possédant même des propriétés “actives” pour lesquelles il était attendu une amélioration des symptômes comme la mémoire de travail, l’inattention et l’hyperactivité/l’impuisivité.37,38
Aucune des études comparant le neurofeedback avec des médicaments stimulants n’a utilisé d’attribution randomisée. Les participants ont eux-mêmes pris le traitement de leur choix. Ceci peut compromettre les résultats, même si ce choix peut potentiellement maximiser les effets espérés dans les deux groupes. L’impossibilité de trouver une différence significative entre les traitements dans de petites études non randomisées (possiblement une erreur de type 2) ne prouve pas que le neurofeedback est aussi bénéfique que les médicaments stimulants. Des études supplémentaires utilisant la randomisation et des échantillons de plus grande taille sont nécessaires pour examiner plus en détail l’action du neurofeedback par rapport aux médicaments stimulants dans le traitement de TDAH.
Publication dans des périodiques non répertoriés
Beaucoup d’études ont par le passé été publiées seulement dans des périodiques spécifiques au neurofeedback comme le “Journal of Neurotherapy” (non répertorié sur Medline) et “Applied Psychophysiology and Biofeedback”. Comme il est possible de le voir dans le Tableau 1, la plupart des études récentes ont été publiées dans des périodiques avec un facteur d’impact plus important et qui sont répertoriés sur Medline comme “Biological Psychiatry”, “Neuroscience Letters” et “Pediatrics”.
Effets à long-terme
Les effets à long terme n’ont pas pu être abordés dans cette méta-analyse. Cependant, plusieurs études ont rapporté des résultats de suivis. Heinrich et al.’ ont réalisé un suivi de 3 mois pour le groupe SCP et ont constaté l’amélioration de toutes les mesures avec le temps (Heinrich, communication privée : Résultats non publiés). En ce qui concerne l’étude de Strehl and colleagues30 qui montre un suivi de 6 mois sur l’évaluation des résultats de l’impulsivité, l’inattention et l’hyperactivité, qui ont continué à s’améliorer après la fin du traitement.11,30 Un suivi de 2 ans dans cette étude41 a montré que toutes les améliorations du comportement et de l’attention se sont révélées stables. Les résultats des tests sur l’attention et de l’évaluation de la famille se sont encore améliorés. De plus, les compétences d’autorégulation de l’EEG se sont révélées être conservées, indiquant que les enfants ont conservé la capacité de bien réguler leur activité cérébrale.
Pris dans leur ensemble, il est possible de conclure que les effets cliniques du neurofeedback sont stables et peuvent même s’améliorer avec le temps. Cela diffère des médicaments stimulant car il est connu que quand les médicaments sont arrêtés, les plaintes initiales recommencent et de récentes preuves ont montré que les traitements temporaires avec des médicaments ne présenteront pas de résultats sur le long-terme.42
Différences pré et post QEEG
Pour conclure, il est souvent mentionné que les études ne constatent pas, ou ne réussissent pas à constater, les différences pré et post QEEG depuis lors que l’EEG est la base du traitement par neurofeedback (consulter par exemple Loo et Barkley13). Cependant, ce n’est pas une raison suffisante pour critiquer l’efficacité clinique du neurofeedback ou de tout autre traitement. La question principale ici est “cela fonctionne-t-il ?” et une question secondaire, non abordée dans cet article, est “comment cela fonctionne-t-il ?”. D’autres essais cliniques sur les médicaments psychoactifs ou sur d’autres techniques de neuro-modulation ne montrent pas cela non plus. Par exemple, une étude sur les données pré et post QEEG et PE (Potentiel Évoqué) après 20 sessions de Stimulation Magnétique Transcranienne rapide (rTMS) chez des patients souffrant de dépression ont également échouées dans la découverte de différences pré et post QEEG, mais ont découvert des changements localisés dans le PE.43 Le traitement rTMS est également basé l’hypothèse de l’asymétrie frontale, également régulièrement évoquée dans les études sur l’EEG.44,45 Curieusement, plusieurs études ont constaté une normalisation des PE comme résultat du neurofeedback7,17,31 comme visible dans le Tableau 1, suggérant que l’EEG (ou les PE) associé aux tâche devrait être étudié plus en profondeur plutôt que l’EEG passif yeux ouverts/yeux fermés. Selon nous, l’EEG passive comme l’EEG yeux ouverts/yeux fermés devrait être considéré comme un marqueur ou phénotype46,48 stable et de ce fait ne devrait pas être considéré comme un paramètre de traitement valide, alors que les questionnaires de comportement spécifiques au trouble et/ou les événements associés aux EEG ou aux PE devraient être les principaux paramètres de traitement.
CONCLUSION
Avec l’inclusion d’études très récentes et fiables dans cette méta-analyse, beaucoup de facteurs de confusion potentiels ont été résolus et les effets cliniques du neurofeedback dans le traitement de TDAH peuvent être considérés comme pertinents, avec une TE importante pour l’inattention et l’impulsivité et une TE modérée pour l’hyperactivité.
Les trois tests randomisés contrôlés de Bakhshayesh,29 Gevensleben et al.10 et Holtmann et al.17 ont montré que le neurofeedback est supérieur à un groupe de contrôle (semi-actif). Les groupes de contrôle semi-actif dans ces études peuvent être considérés comme des contrôles de placebo pertinents, fournissant un niveau équivalent d’entraînement cognitif et d’interaction client-thérapeute. Par conséquent, selon les directives pour l’évaluation de l’efficacité clinique, nous concluons que le traitement par neurofeedback pour le TDAH peut être considéré “Efficace et Précis” (niveau 5) avec une TE importante pour l’inattention et l’impulsivité et une TE modérée pour l’hyperactivité.
REMERCIEMENTS
Nous souhaitons remercier les personnes suivantes de nous avoir fournis de plus amples informations pour la méta-analyse : Hartmut Heinrich, Petra Studer, Jochen Kaiser, David Kaiser, Michael Linden, Johanne Lévesque, Martin Holtmann, Ulrike Leins, Domenic Greco, André Achim, Geneviève Plusau et Ali Reza Bakhshayesh. Nous souhaitons également remercier Desirée Spronk pour son soutient dans l’élaboration de ce manuscrit.
DIVULGATION ET CONFLITS D’INTÉRÊT
U. Strehl et A. Coenen n’ont pas de conflits d’intérêts par rapport à cet article. S. de Ridder et M. Arns travaillent pour Braindinics Treatment, une clinique qui soigne des patients par neurofeedback et la rTMS. M. Breteler travaille pour EEG Resource Institute, clinique où des patients sont traités par neurofeedback.
REFERENCES
- Lubar JF, Shouse MN. EEG and behavioural changes in a hyperkineticchild concurrent with training of the sensorimotor rhythm (SMR): a preliminary report. Biofeedback Self Regul 1976; 3: 293-306.
- Howe RC, Sterman MB. Cortical-subcortical EEG correlates of suppressedmotor behaviour during sleep and waking in the cat. J Electroencephalogr Clin Neurophysiol 1972; 32: 681-695.
- Chase MH, Harper RM. Somatomotor and visceromotor correlates of opreantly conditioned 12-14 c.sec sensorimotor cortical activity. J Electroencephalogr Clin Neurophysiol 1971; 31: 85-92.
- Sterman MB, MacDonald LT, Stone RK. Biofeedback training of thesensorimotor electroencephalographic rhythm in man: effects on epilepsy. Epilepsia 1974; 15: 395-416.
- Shouse MN, Lubar JF. Operant conditioning of EEG rhythms and Ritalin in the treatment of hyperkinesis. Biofeedback Self Regul 1979; 4(4): 299-311.
- Monastra VJ, Lynn S, Linden M, Lubar JF, Gruzelier J, LaVaque TJ. Electroencepaholographic biofeedback in the treatment of attention-deficit/hyperactivity disorder. Appl Psychophysiol Biofeedback 2005; 30(2): 95-113.
- Heinrich H, Gevensleben H, Freisleder FJ, Moll GH, Rothenberger A.Training of slow cortical potentials in attention-deficit/hyperactivitydisorder: evidence for positive behavioral and neurophysiological effects.Biol Psychiatry 2004; 55: 772-775.
- Egner T, Sterman MB. Neurofeedback treatment of epilepsy: from basic rationale to practical implication. Expert Rev Neurotherapeutics 2006; 6(2):247-257.
- Kleinnijenhuis M, Arns M, Spronk D, Breteler R. Comparison of discretetrial based SMR and SCP training and the interrelationship between SCP and SMR networks: implications for brain-computer interfaces and neurofeedback.J Neurotherapy 2007; 11(4): 19-35.
- Gevensleben H, Holl B, Albrecht B, Vogel C, Schlamp D, Kratz O, et al. Is neurofeedback an efficacious treatment for ADHD? A randomised controlled clinical trial. J Child Psychol Psychiatry 2009; Jan. 12 [Epub ahead of print].
- Leins U, Goth G, Hinterberger T, Klinger C, Rumpf N, Strehl U. Neurofeedback for children with ADHD: a comparison of SCP and theta/beta protocols. Appl Psychophysiol Biofeedback 2007; 32(2): 73-78.
- LaVaque TJ, Hammond DC, Trudeau D, Monastra VJ, Perry J, Lehrer P. Template for developing guidelines for the evaluation of the clinical efficacy of psychophysiological interventions. Appl Psychophysiol Biofeedback 2002; 27(4): 273-281.
- Loo SK, Barkley RA. Clinical utility of EEG in attention deficit hyperactivity disorder. Appl Neuropsychol 2005; 12(2): 64-76.
- Holtmann M, Stadler C. Electroencephalographic biofeedback for the treatment of attention-deficit hyperactivity disorder in childhood and adolescence. Expert Rev Neurotherapeutics 2006; 6(4): 533-540.
- American Psychiatric Association. Diagnostics and Statistical Manual of Mental Disorders. (4th ed.) Washington, DC; 1994.
- Hammond C. Comprehensive neurofeedback bibliography: 2007 update. J Neurotherapy 2007; 11(3): 45-60.
- Holtmann M, Grasmann D, Cionek-Szpak E, Hager V, Panzer N, Beyer A, et al. Spezifische Wirksamkeit von Neurofeedback auf die Impulsivitat bei ADHS – Literaturuberblick und Ergebnisse einer prospective, kontrollierten Studie. Kindheit und Entwicklung 2009; 18: 95-104.
- Drechsler R, Straub M, Doehnert M, Heinrich H, Steinhausen H, Brandeis Controlled evaluation of a neurofeedback training of slow cortical potentials in children with ADHD. Behav Brain Funct 2007; 3:35.
- Carlson KD, Schmidt FL. Impact of experimental design on effect size: findings from the research literature on training. J Appl Psychol 1999; 84:851-862.
- Morris SB. Estimating effect sizes from pretest-posttest-control group designs. Org Res Methods 2008; 11(2): 364-386.
- Rosenberg MS, Adams DC, Gurevitch J. MetaWin. Statistical Software for Meta-Analysis. Version 2.1. Sunderland MA: Sinauer Associates; 2000.
- Linden M, Habib T, Radojevic V. A controlled study of the effects of EEG biofeedback on cognition and behavior of children with attention deficit disorder and learning disabilities. Biofeedback Self Regul 1996; 21(1): 35-49.
- Lubar JF, Swartwood MO, Swartwood JN, O’Donnell PH. Evaluation of the effectiveness of EEG neurofeedback training for ADHD in a clinical setting as measured by changes in T.O.V.A. scores, behavioral ratings, and WISC-R performance. Biofeedback Self Regul 1995; 20(1): 83-99.
- deBeus R. Efficacy of attention training for children with ADHD: a randomized double-blind placebo-controlled study. Presented at the ISNR conference, Atlanta, GA, USA, 7–10 September 2006.
- Picard BA. Double blind sham study of neurofeedback treatment for children with ADHD. Presented at the ISNR conference, Atlanta, GA, USA, 7–10 September 2006.
- Fine AH, Goldman L, Sandford J. Innovative techniques in the treatment of ADHD: an analysis of the impact of EEG Biofeedback training and a cognitive computer generated training. Presented at the American Psychological Association, Los Angeles, CA, 1994.
- Fuchs T, Birbaumer N, Lutzenberger W, Gruzelier JH, Kaiser J. Neurofeedback treatment for attention deficit/hyperactivity disorder in children: a comparison with methylphenidate. Appl Psychophysiol Biofeedback 2003; 28: 1-12.
- Rossiter TR. The effectiveness of neurofeedback and stimulant drugs in treating AD/HD: Part II.Replication. Appl Psychophysiol Biofeedback 2004;29(4): 233-243.
- Bakhshayesh AR. Die Wirksamkeit von Neurofeedback im Vergleich zum EMG-Biofeedback bei der Behandlung von ADHS-Kindern. PhD thesis, Universität Potsdam, Germany 2007 (submitted J Child Psychol Psychiatry).
- Strehl U, Leins U, Goth G, Klinger C, Hinterberger T, Birbaumer N. Selfregulation of slow cortical potentials: a new treatment for children with attention-deficit/hyperactivity disorder. Pediatrics 2006; 118: 1530-1540.
- Kropotov JD, Grin-Yatsenko VA, Pomarev VA, Chutko LS, Yakovenko EA, Nikishena IS. ERPs correlates of EEG relative beta training in ADHD children. Int J Psychophysiol 2005; 55: 23-34.
- Xiong Z, Shi S, Xu H. A Controlled study of the effectiveness of EEG biofeedback training on children with attention deficit hyperactivity disorder. J Huazhong Univ Science Tech 2005; 25(3): 368-370.
- Monastra VJ, Monastra DM, George S. The effects of stimulant therapy, EEG biofeedback, and parenting style on the primary symptoms of attention-deficit/hyperactivity disorder. Appl Psychophysiol Biofeedback 2002; 27(4): 231-249.
- Kaiser DA, Othmer S. Effects of neurofeedback on variables of attention in a large multi-center trial. J Neurotherapy 2000; 4(1): 5-15.
- Levesque J, Beauregard M, Mensour B. Effect of neurofeedback training on the neural substrates of selective attention in children with attentiondeficit/hyperactivity disorder: a functional magnetic resonance imaging study. Neurosci Lett 2006 ; 394(3): 216-221.
- Cohen J. A power primer. Psychol Bull 1992; 112: 155-159.
- Toplak ME, Conner L, Shuster J, Knezevic B, Parks S. Review of cognitive, cognitive-behavioral, and neural-based interventions for attentiondeficit/hyperactivity disorder (ADHD). Clin Psychol Rev 2008; 18: 801-823.
- Klingberg T, Fernell E, Elesen P, Johnson M, Gustafsson P, Dahlstrom K, et al. Computerized training of working memory in children with ADHD: a randomized controlled trial. J Am Acad Child Psy 2005; 44(2): 177-186.
- Orlandi MA, Greco D. A randomized, double-blind clinical trial of EEG neurofeedback treatment for attention deficit/hyperactivity disorder (ADHD). Presented at the ISNR conference, 2005.
- Rossiter TR, La Vaque TJ. A comparison of EEG biofeedback and psychostimulants in treating attention deficit/hyperactivity disorders. J Neurotherapy 1995; 1: 48-59.
- Gani C, Birbaumer N, Strehl U. Long term effects after feedback of slow cortical potentials and of theta-beta-amplitudes in children with attentiondeficit/hyperactivity disorder (ADHD). Int J Bioelectromagn 2008; 10(4):209-232.
- Molina BS, Hinshaw SP, Swanson JM, Arnold LE, Vitiello B, Jensen PS, et Prospective follow-up of children treated for combined type ADHD in a multisite study. J Am Child Adolesc Psych 2009; 48(5): 461-462.
- Spronk D, Arns M, Bootsma A, van Ruth R, Fitzgerald P. Long term effects of left frontal rTMS on EEG and ERP’s in patients with depression. EEG Clin Neurosci 2008; 39(3): 118-124.
- Baehr E, Rosenfeld JP, Baehr R, Earnest C. Comparison of two EEG asymmetry indices in depressed patients vs. normal controls. Int J Psychophysiol 1998; 31: 89-92.
- Baehr E, Rosenfeld JP, Baehr R. Clinical use of an alpha asymmetry neurofeedback protocol in the treatment of mood disorders: follow-up study one to five years post therapy. J Neurotherapy 2001; 4(4): 11-18.
- Johnstone J, Gunkelman J, Lunt J. Clinical database development:characterization of EEG phenotypes. Clin EEG Neurosci 2005; 36(2):99-107.
- Arns M, Gunkelman J, Breteler M, Spronk D. EEG phenotypes predict treatment outcome to stimulants in children with ADHD. J Integr Neurosci 2008; 7(3): 421-438.
- Arns M. Personalized medicine: Nieuwe ontwikkelingen in de diagnostiek en behandeling van Depressie en ADHD. De Psycholoog 2008; 9: 470-475.
Neurothérapeute spécialiste en traitement de l’hyperactivité par le neurofeedback – Psychothérapeute
Cabinet : 2 Place Malvesin, 92400 Courbevoie (aux portes de Paris)
Mentions légales et conditions d’utilisation – Charte de confidentialité et de sécurité